Was Nervenzellen auszeichnet: Genregulatorische Mechanismen, die zur Identität und Funktion von Neuronen notwendig sind
Forschungsbericht (importiert) 2020 - Max-Planck-Institut für Immunbiologie und Epigenetik
Genregulation innerhalb von Neuronen
Nervenzellen, auch Neuronen genannt, sind in ihrer Form und Funktion hochkomplex. Sie bilden zahlreiche Synapsen, von denen jede Einzelne mit akkurater Information gespeist werden muss, um das richtige Funktionieren aller Körperfunktionen zu ermöglichen. Auf der Ebene der Moleküle sind bestimmte RNAs entscheidend für die Gesundheit des Nervensystems: Nahezu jede bekannte neurologische oder neurodegenerative Erkrankung beim Menschen ist mit einer Fehlfunktion der RNA-Regulation verbunden.
Wichtige Aufgaben für Neuronen-spezifische RNAs
Während der Genexpression werden von der DNA sogenannte Boten-RNA-Moleküle – mRNAs – transkribiert und später in Proteine übersetzt. Bestimmte Regionen des mRNA-Moleküls werden allerdings nicht in ein Protein übersetzt, sondern übernehmen regulatorische Funktionen. So zum Beispiel die sogenannte 3‘-untranslatierte Region (3‘-UTR), die der Protein-kodierenden Region auf der mRNA folgt. Die 3‘-UTR kann bestimmen, wann und wo ein Gen aktiv wird oder wo in der Zelle ein Protein seinen Platz finden soll.
Unsere Forschung widmet sich verschiedenen RNA-Prozessierungsmechanismen, die die neuronale Entwicklung und Funktion steuern. Dabei konzentrieren wir uns auf ein Phänomen, das nur in Nervenzellen vorkommt: die umfangreiche Verlängerung der 3‘-UTR bei Hunderten von mRNAs im Verlauf der Embryonalentwicklung. Diese 3‘-UTR-Verlängerung ist für Neuronen von entscheidender Bedeutung, damit die Nervenzellen ihre Identität bewahren und richtig funktionieren können.
Als Modellorganismus dient uns die Fruchtfliege Drosophila melanogaster. Die Tiere vermehren sich schnell und mit zahlreicher Nachkommenschaft und ermöglichen es, die gesamte Entwicklung des Nervensystems nachzuverfolgen. Bei Fliegen und Menschen funktionieren und entwickeln sich Neuronen sehr ähnlich. Viele Gene, die beim Menschen ausschlaggebend sind für neuronale Entwicklungsstörungen und neurodegenerativen Erkrankungen, sind ursprünglich in Drosophila entdeckt worden. Ebenso sind die gleichen Proteine und Steuerungsprozesse an der Regulierung und Aufrechterhaltung der neuronalen Funktionen beteiligt. Wir untersuchen diese Moleküle und ihre Funktion in der Fliege, um damit auch das Nervensystem des Menschen besser verstehen zu können.
ELAV als Master-Regulator der neuronalen RNA-Identität
Eines der am stärksten in der Evolution konservierten Proteine ist ELAV. Dieses RNA-bindende Protein findet sich nicht nur in Drosophila, sondern in den Nervenzellen eines jeden Tieres. Beim Menschen sind ELAV-Proteine an zahlreichen neurologischen Krankheiten beteiligt. Die konkreten Mechanismen, wie ELAV die Gesundheit von Nervenzellen beeinflussen, sind aber noch nicht eindeutig verstanden.
Unsere Forschung konnte zeigen, dass ELAV die Prozesse der 3‘-UTR-Verlängerung und die Synthese von Spleiß-Isoformen in Neuronen steuert. Bevor nämlich eine reife mRNA aus dem Zellkern ins Zytoplasma transportiert und dort in Proteine übersetzt werden kann, wird das Molekül einer Reihe von Modifikationen unterworfen: Introns werden durch Spleißen entfernt und es kommt zur sogenannten Polyadenylierung, bei der zuvor Teile der RNA am 3‘-UTR-Ende abgetrennt werden. In Neuronen bindet ELAV allerdings bereits während der Transkription an die Polyadenylierungs-Positionen der neu entstehenden mRNA, hemmt dadurch die Spaltung und lässt die Transkription über die normale Endsequenz hinaus fortschreiten, sodass eine deutlich verlängerte 3‘-UTR gebildet wird.
Es stellte sich heraus, dass ELAV ein sogenannter „Master-Regulator“ ist. In der Biologie sind Master-Regulatoren Moleküle, von denen man annimmt, dass sie für die Steuerung eines ganzen Regulationsprogramms innerhalb der Zelle verantwortlich sind. Sie stellen also sicher, dass mehrere wichtige, transformative Ereignisse stattfinden. Es ist jedoch gefährlich für die Zelle, sich vor allem bei wichtigen Aufgaben nur auf einen einzigen Effektor zu verlassen. Deshalb teilen sich in vielen biologischen Systemen in der Regel mehrere Proteine die Arbeit.
Der EXAR-Mechanismus als Ersatzspieler
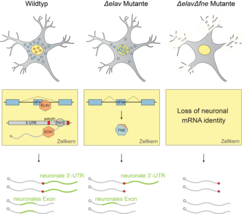
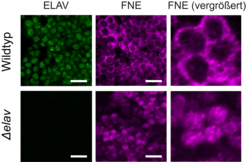
Wir fanden ein ungewöhnlich robustes System, das die Bildung und Aufrechterhaltung neuronaler Transkript-Signaturen gewährleistet. Unter normalen Bedingungen fungiert ELAV als Master-Regulator und leitet die Synthese neuronaler 3‘-UTRs und Spleiß-Isoformen im Alleingang an. Interessanterweise unterdrückt das Protein aber auch die Expression einer Spleiß-Isoform eines anderen Gens der ELAV Familie namens FNE (Abb. 1).
Als wir ELAV durch Mutation ausschalteten, konnten wir zeigen, dass eine neue, aktivierte Form von FNE in der Zelle exprimiert wird. Diese wird in den Kern verlagert, um die Funktion von ELAV in dessen Abwesenheit zu übernehmen. Wir nennen diesen bisher unbekannten „hierarchischen“ Mechanismus der Funktionsübernahme EXAR (EXon-Activated Rescue, Abb. 2).
Funktion von Neuronen-spezifischen, nicht-kodierenden RNAs
In weiteren Studien untersuchen wir, wie RNA-bindende Proteine auf die RNA wirken, um die Gesundheit von Nervenzellen zu erhalten. Zum Beispiel haben wir herausgefunden, dass eine bisher unbekannte, nicht-kodierende RNA für die Bildung sogenannter neuronaler Körperchen notwendig ist. Diese Körperchen, die aus einem dichten Zusammenschluss aus RNAs und RNA-bindenden Proteinen bestehen, sind vor allem für ihre Rolle in synaptischen Prozessen wie beispielsweise der Konsolidierung von Erinnerungen bekannt. Auch zukünftig wollen wir die Auswirkung verschiedenster RNA-Mechanismen in Neuronen aufschlüsseln und diese Erkenntnisse im Kampf für den Erhalt funktionierender Nervenzellen im Kontext der menschlichen Gesundheit zu nutzen.

