Zelluläre Kondensate ans Licht bringen
Neue lichtbasierte Mikroskopiemethode ermöglicht es, biomolekularer Kondensate in lebenden Zellen gezielt zu untersuchen und zu verändern
Forschende am MPI für Immunbiologie und Epigenetik haben LiTEC entwickelt, eine bahnbrechende Methode zur Untersuchung biomolekularer Kondensate – membranlose Kompartimente in Zellen, die zentrale Prozesse wie die Genexpression regulieren. Die Technologie nutzt Licht und beliebige Frachten, um proteomische Analysen in diesen dynamischen molekularen Clustern zu ermöglichen. LiTEC liefert neue Einblicke in die Zusammensetzung und das Verhalten von Kondensaten, ohne ihren natürlichen Zustand zu stören.

In Schulbüchern werden tierische Zellen meist als membranumhüllte Bläschen dargestellt, die mit kleineren, ebenfalls membranumhüllten Zellbereiche gefüllt sind. Die Realität sieht jedoch anders aus als dieses vereinfachte Bild. Natürlich gibt es in lebenden Zellen viele membranumhüllte Zellorganellen wie Mitochondrien oder Lysosomen. Es gibt aber auch viele Bereiche, die nicht von einer Membran umschlossen sind, aber ebenso wichtige Funktionen erfüllen. Diese werden als biomolekulare Kondensate bezeichnet und bestehen im Wesentlichen aus molekularen Clustern, die mit Proteinen, DNA und RNA gefüllt sind. Sie sind vom Rest der Zelle durch eine biochemische Affinitätsgrenze getrennt.
„Biomolekulare Kondensate haben faszinierende physikalische Eigenschaften. Zellen nutzen diese Eigenschaften, um ideale Mikroumgebungen für biochemische Reaktionen zu schaffen“, erklärt Choongman Lee vom Max-Planck-Institut für Immunbiologie und Epigenetik in Freiburg und Erstautor der Studie.
Wie man Kondensate in lebenden Zellen untersucht
Es wird vermutet, dass Zellen mit Hilfe von Kondensaten ihre innere Umgebung präzise regulieren und so Prozesse wie die Genregulation ermöglichen. Mit Hilfe der Super-Resolution-Mikroskopie hat das Labor von Ibrahim Cissé bereits transkriptionelle Kondensate, die aus RNA-Polymerase II und einem Mediator bestehen, in embryonalen Stammzellen der Maus entdeckt. Anfang dieses Jahres (Du et al Cell 2024) konnte das Team zudem zeigen, dass diese Kondensate das so genannte „dynamische Kissing“ der Genexpression steuern: Die direkte Interaktion zwischen Kondensat und Gen ist viel dynamischer als bisher angenommen und führt zu einer Verstärkung der Genexpression durch Gen-Bursting. Die Zusammensetzung dieser Kondensate ist jedoch mit herkömmlichen biologischen Methoden wie Massenspektrometrie, Proteomik oder genomischen Ansätzen schwer zu bestimmen.
„Aufgrund ihrer geringen Größe und ihrer dynamischen Natur sind diese Kondensate in ihrem natürlichen Milieu, also in lebenden Zellen, besonders schwierig zu untersuchen. Ihre geringe Größe von nur wenigen hundert Nanometern und ihre flüssigkeitsähnlichen Eigenschaften machen es besonders schwierig, sie zu isolieren, und die Fixierung von Zellen während des Versuchs verändert oft ihre natürliche Zusammensetzung, was die Identifizierung ihrer tatsächlichen Bestandteile zusätzlich erschwert“, erklärt Ibrahim Cissé, Max-Planck-Direktor in Freiburg.
Eine neue Technologie wird benötigt
Um aber die biophysikalischen Eigenschaften und biologischen Funktionen zellulärer Kondensate besser zu verstehen, müssen diese Komponenten in ihrer natürlichen Umgebung, also den lebenden Zellen, untersucht werden. In einer kürzlich in der Fachzeitschrift Cell veröffentlichten Studie stellte das Team um Ibrahim Cissé des Max-Planck-Instituts in Freiburg eine neuartige Methode namens LiTEC (engl. Light-induced Targeting of Endogenous Condensates) vor. Im Gegensatz zu herkömmlichen Techniken, die auf chemischer oder mechanischer Extraktion basieren, ermöglicht LiTEC die direkte Untersuchung und Manipulation von Kondensaten in lebenden Zellen.
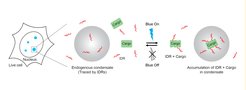
Das LiTEC-System nutzt sogenannte intrinsisch ungeordnete Regionen (IDRs) bestimmter Proteine, die sich natürlicherweise in Kondensaten ansammeln und als molekulare „Postleitzahlen“ dienen, um diese präzise anzusteuern. Mit belichtungsabhängigen Prozessen koppelt LiTEC die IDRs an beliebige Frachtmoleküle und reichert diese gezielt in den Kondensaten an. Diese gezielte Anreicherung erhöht die enzymatische Aktivität innerhalb der Kondensate und ermöglicht es den Forschern, deren Zusammensetzung und Verhalten mithilfe des Massenspektrometers zu analysieren.
„In unserem Proof-of-Concept haben wir uns auf Transkriptionskondensate konzentriert, insbesondere auf die schwer zu isolierenden Kondensate von RNA-Pol II und Mediatoren in Säugetierzellen. Prinzipiell kann derselbe LiTEC-Ansatz jedoch problemlos auf andere endogene Kondensate angewendet werden. Durch die Auswahl unterschiedlicher ‚Postleitzahlen‘ kanndie Technik auch auf andere Kondensate gezielt werden. Mit verschiedenen Frachten könnten theoretisch auch andere genomweite Studien an endogenen Kondensaten durchgeführt werden“, erklärt Ibrahim Cissé.
Es ist auch denkbar, dass LiTEC eingesetzt wird, um die biophysikalischen Eigenschaften von Kondensaten zu manipulieren, indem spezifische Marker konzentriert werden, um sie entweder aufzulösen oder zu verfestigen und so ihre biologischen Funktionen zu beeinflussen. Insgesamt eröffnet das LiTEC-System neue Möglichkeiten für die Proteomik und bietet ein erhebliches Potenzial für eine Vielzahl von Anwendungen in der Kondensatforschung.
IC/CL/MR

