Von Fischen lernen: Thymusentwicklung beim Zebrabärbling
Forschungsbericht (importiert) 2009 - Max-Planck-Institut für Immunbiologie und Epigenetik
Immunologische Forschung wird nur zum Teil am Menschen durchgeführt, für die meisten Experimente werden Tiermodelle verwendet. Typischerweise sind die immunologischen Tiermodelle Nagetiere, und zwar in erster Linie Maus und Ratte. Während der letzten 50 Jahre wurden viele bahnbrechende Entdeckungen der Immunologie mit Untersuchungen an diesen Tierarten gemacht. Das Repertoire an Methoden und Reagenzien für immunologische Experimente ist für keinen anderen Modellorganismus so reichhaltig wie für diese Nagetiere. Warum also macht man sich die Mühe, mit dem Zebrabärbling einen bis vor wenigen Jahren nur für Studien zur Embryonalentwicklung verwendeten Zierfisch als weiteren Modellorganismus in das Feld der Immunologie einzuführen?
Warum an Fischen forschen?
Der Zebrabärbling (Danio rerio, Abb. 1) wurde bereits vor seiner „Entdeckung“ als Versuchstier für die Wissenschaft häufig als Aquarienfisch gehalten, da er recht anspruchslos und ausgesprochen leicht zu züchten ist. Für die Forschung interessant ist er vor allem aus folgenden Gründen:

Zebrabärblinge sind außerordentlich fruchtbar. Ein gesundes Weibchen kann im Abstand von zwei Wochen bis zu 700 Eier legen. Für genetische Studien wie etwa die Kartierung von mutierten Genen mittels Kopplungsanalyse ist dies ein großer Vorteil, da die für genetische Untersuchungen in der Regel notwendige hohe Zahl an Nachkommen in kürzester Zeit erreicht werden kann.
Die Sequenzierung des Genoms des Zebrabärblings hat gezeigt, dass er sich, was Zahl und Art der Gene angeht, weit weniger von höheren Wirbeltieren unterscheidet, als man zunächst denken könnte. Mittlerweile hat man auch eine Reihe von menschlichen Erkrankungen im Zebrabärbling „nachbilden“ können (zum Beispiel Hautkrebs, Leukämie, verschiedene Kardiomyopathien etc.), und eine ganze Reihe von Erbkrankheiten zeigen beim Zebrabärbling dasselbe Erscheinungsbild und beruhen auf Defekten der gleichen Gene wie beim Menschen. Daher hat sich der Zebrabärbling in den letzten Jahren auch zu einem Modellorganismus für die biomedizinische Forschung entwickelt, der sich gegenüber anderen Modellorganismen nicht zuletzt durch geringeren Platzbedarf und Pflegeaufwand auszeichnet.
Wie bei den meisten Knochenfischen findet beim Zebrabärbling die gesamte Entwicklung von der befruchteten Eizelle bis zur fertig ausgebildeten Larve außerhalb des Muttertieres statt. Dieser Prozess kann daher bei diesen Fischen – anders als bei höheren Wirbeltieren wie etwa Maus oder Mensch – ohne weiteres beobachtet und vor allem auch manipuliert werden. Von großem Vorteil für die Forscher ist darüber hinaus die außerordentliche Geschwindigkeit der Embryonalentwicklung beim Zebrabärbling: Innerhalb weniger Tage entwickelt sich aus dem Ei eine freischwimmende Larve, die bereits fast alle Organe ausgebildet hat, die ein Wirbeltier besitzt. Diese Eigenschaften machen den Zebrabärbling zu einem beliebten Untersuchungsobjekt für die Entwicklungsbiologie, weil von der ersten Zellteilung an bis zur Organogenese alle Entwicklungsvorgänge live beobachtet werden können.
Welche Funktion hat der Thymus?
Im Überlappungsbereich der drei bisher erwähnten Forschungsfelder Genetik, Biomedizin und Entwicklungsbiologie sind auch die Projekte der Forschungsgruppe um Michael Schorpp angesiedelt. Im Mittelpunkt ihres Interesses steht der Thymus, ein Organ von zentraler Bedeutung für das Immunsystem. Eine der beiden Zellpopulationen, die bei der Immunabwehr die Hauptrolle spielen, wird im Thymus gebildet. Diese sogenannten T-Zellen kommen in unserem Körper hauptsächlich in zwei Formen vor: als Killerzelle und als Helferzelle. Killerzellen eliminieren zum Beispiel Zellen, die mit Viren infiziert sind. Helferzellen aktivieren diejenigen Zellen des Immunsystems, die Antikörper herstellen, und steuern zahlreiche andere Prozesse der Immunreaktion. Es muss sichergestellt sein, dass beide Zelltypen nur körperfremdes Material erkennen und angreifen. Da das Oberflächenmolekül, mit dem eine Killer- oder Helferzelle körperfremdes Material als solches erkennt, aber nach dem Zufallsprinzip aus verschiedenen Komponenten zusammengesetzt wird, ist es unvermeidlich, dass aus Zufall auch Zellen entstehen, die körpereigenes Material erkennen. Diese müssen aussortiert werden, bevor sie im Immunsystem aktiv werden können. Die Eliminierung von solchen autoreaktiven T-Zellen ist die Aufgabe des Thymus. Gleichzeitig fördert der Thymus aber die Reifung derjenigen T-Zellen, die diese Auslese überstanden haben. Menschen, denen der Thymus von Anfang an fehlt oder bei denen seine Funktion gestört ist, leiden daher entweder unter schweren (meist tödlichen) Defekten der Immunabwehr oder unter Autoimmunkrankheiten. Um solche Krankheiten verstehen und behandeln zu können, muss man zunächst einmal verstehen, wie der Thymus beim gesunden Menschen entsteht und funktioniert.
Kann man Entstehung und Funktion des Thymus an Fischen studieren?
Schlüsseleigenschaften des Immunsystems höherer Wirbeltiere finden sich auch beim Zebrabärbling. So ist zum Beispiel eine Reihe von Genen, die bei der Bildung der T-Zellen bei höheren Wirbeltieren eine Rolle spielen (z. B. ikaros, gata3, lck, rag1), auch beim Zebrabärbling in Geweben aktiv, in denen die T-Zellen entstehen. Das foxn1-Gen, das bei der Maus für die Entwicklung des Thymus unentbehrlich ist, braucht auch der Zebrabärbling, um dieses Organ ausbilden zu können. Daraus lässt sich schließen, dass T-Zell- und Thymusentwicklung in Knochenfischen und Säugetieren im Wesentlichen gleich ablaufen.
Nach Genen für den Thymus fischen
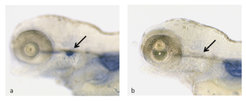
Um herauszufinden, welche weiteren Gene außer den bisher bekannten an der Entstehung des Thymus beteiligt sind, wurde im Zebrabärbling ein sogenannter Mutagenese-Screen durchgeführt. Dabei sucht man in vielen verschiedenen mutierten Zebrabärblingen, bei denen die Thymusentwicklung gestört ist (Abb. 2), nach dem jeweils veränderten Gen. Maßgeblich für die Unterscheidung zwischen Wildtyp und Mutante ist dabei eine veränderte Expression von rag1, einem Gen, das spezifisch in T-Zellen im Thymus aktiv ist. In einem Pilotexperiment konnten drei thymusspezifische Mutanten identifiziert werden. Im sogenannten Tübingen-2000-Screen wurden in Zusammenarbeit mit dem MPI für Entwicklungsbiologie in Tübingen und der Exelixis Germany GmbH etwa 40 weitere Mutanten isoliert. Die Mutationen in den einzelnen mutanten Linien werden gegenwärtig mithilfe der Kopplungsanalyse genetisch kartiert. Bisher konnten auf diese Weise zwölf Gene identifiziert werden, deren Inaktivierung zu Störungen der Thymusentwicklung führen – neben einigen bereits bekannten vor allem solche, die bisher mit dem Thymus noch nicht in Verbindung gebracht worden waren. Das nächste Ziel ist, weitere thymusspezifische Gene zu entdecken, um ein möglichst komplettes Bild davon zu bekommen, welche genetischen Faktoren die Thymusbildung kontrollieren. Sind diese Gene erst einmal beim Zebrabärbling bekannt, weiß man aufgrund der großen genetischen Ähnlichkeit auch beim Menschen, in welchen Genen man den Fehler suchen muss, wenn erbliche Immundefizienzen auftreten.
Organogenese live
Der Thymus entsteht bereits in einem sehr frühen Stadium der Embryonalentwicklung. Vorläufer der T-Zellen wandern zunächst von den Orten, an denen die Blutbildung stattfindet, zur Thymusanlage. Weil dieser Prozess im Embryo stattfindet, kann er bei höheren Wirbeltieren wie etwa der Maus nicht direkt beobachtet werden. Eine Alternative bietet hier der Zebrabärbling. Weil er sich außerhalb des Muttertieres entwickelt, kann seine Embryonalentwicklung leicht beobachtet und manipuliert werden. Will man die Entstehung des Thymus im lebenden Fischembryo beobachten, muss man allerdings die beteiligten Zellen von den anderen Zellen im Embryo unterscheiden können. Mittels gentechnischer Methoden ist es möglich, Fischlinien zu erzeugen, bei denen ein fluoreszierendes Protein ausschließlich in den Zellen hergestellt wird, deren Verhalten man beobachten möchte. Unter dem Fluoreszenzmikroskop können diese Zellen dann im lebenden Embryo verfolgt werden. Doppelfärbungen verschiedener Zellpopulationen sind möglich, indem man zwei Fischlinien miteinander kreuzt, bei denen die beiden Populationen verschiedenfarbig fluoreszierende Proteine herstellen.
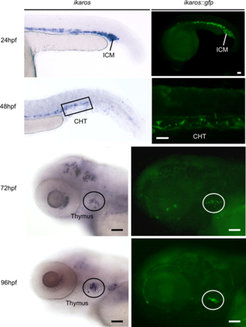
Um das Verhalten der T-Zellen bereits dann studieren zu können, wenn sie noch als Vorläufer auf dem Weg zur Thymusanlage sind, wurden Zebrabärblinge generiert, die ein grün fluoreszierendes Protein in eben diesen T-Zell-Vorläufern produzieren. Diese Fischlinie bietet zum ersten Mal die einzigartige Möglichkeit, die Einwanderung einzelner Vorläuferzellen in die Thymusanlage zu beobachten (Abb. 3). Das Verhalten dieser Zellen kann in diesen Tieren aber nicht nur beobachtet, sondern auch manipuliert werden: In die Eizelle des Zebrabärblings lassen sich Substanzen einbringen, die während der Entwicklung des Embryos sehr spezifisch die Aktivität einzelner Gene verstärken (sog. messenger RNA) oder verringern (sog. antisense-Morpholinos). Werden diese Experimente an den Fischen mit grün fluoreszierenden T-Zell-Vorläufern durchgeführt, lassen sich die Effekte dieser Substanzen live studieren. Man kann auf diese Weise sehr schnell herausfinden, ob und in welchem Stadium das jeweilige Gen an der Thymusbildung beteiligt ist.
In naher Zukunft werden auch Zebrabärblinge zur Verfügung stehen, bei denen das Ziel der T-Zell-Vorläufer, die Thymusanlage, rot fluoresziert. Mithilfe der beiden Fischlinien wird es dann möglich sein, sowohl Herkunft und Verhalten der Vorläufer und Entstehung der Organanlage, als auch frühe Interaktionen zwischen beiden Zelltypen im lebenden Embryo auf zellulärem Niveau zu beobachten und zu analysieren.


