Auch für Stammzellen gilt: Man ist, was man isst
Freiburger Stammzellforschung zeigt, wie ein Vitamin A-Abfallprodukt Zellfunktionen bei der Blutbildung steuert
Blutstammzellen im Knochenmark sorgen dafür, dass unser Blutsystem lebenslang mit neuen Zellen versorgt wird – insbesondere in Stresssituationen wie Infektionen oder bei Entzündungen. Werden die Blutstammzellen nicht gebraucht, verbleiben viele von ihnen in einem Ruhezustand, um ihr einzigartiges Potenzial zu schützen. Das Labor von Nina Cabezas-Wallscheid am Max-Planck-Institut für Immunbiologie und Epigenetik in Freiburg erforscht die komplexen regulatorischen Netzwerke zum Erhalt dieser außergewöhnlichen Fähigkeiten. Das Team hat nun herausgefunden, wie ein einziger Vitamin A-Metabolit, der bisher als Abfallprodukt galt, wichtige Funktionen der Blutstammzellen reguliert.
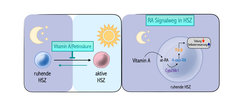
Blutstammzellen, die auch hämatopoetische Stammzellen (HSZ) genannt werden, sind ein faszinierender Zelltyp und bilden die Grundlage unseres Blutsystems. Die Zellen sitzen hauptsächlich im Knochenmark und haben als einzige das Potenzial, das gesamte Blutsystem langfristig mit neuen Zellen zu versorgen. Vor allem in Stresssituationen wie Virusinfektionen oder bei schwerem Blutverlust werden HSZ aktiviert und können jede der unterschiedlichen Blutzelltypen bilden, einschließlich der Leukozyten, die Teil unseres Immunsystems sind. Sobald jedoch HSZ aktiviert werden und sich teilen, können diese Zellen „verschleißen“ und möglicherweise Mutationen erwerben, die zu bösartigen Transformationen und Blutkrebs führen. Aus diesem Grund befinden sich viele HSZ in einem sehr tiefen Ruhezustand, in dem sie sich nicht teilen und einen sehr geringen Energiebedarf haben.
Nina Cabezas-Wallscheid und ihr Team am MPI für Immunbiologie und Epigenetik interessieren sich für das Schicksal dieses seltenen Zelltyps. Sie wollen verstehen, wie die grundlegenden Stammzellfunktionen reguliert und bewahrt werden. „Ein Ansatz, den unser Labor verfolgt, ist die Untersuchung des Stoffwechsels von HSZ. In den letzten Jahren wurde immer deutlicher, dass Zwischen- und Endprodukte von Stoffwechselprozessen eine aktive Rolle bei der Regulierung von Zellfunktionen spielen,“ sagt Nina Cabezas-Wallscheid.
Der Stoffwechsel beeinflusst Schicksal und Funktionen der Zelle
Der Zellstoffwechsel ist die Gesamtheit der biochemischen Reaktionen, die zur Umwandlung von Nährstoffen in essenzielle zelluläre Prozesse stattfinden. Daher ist er von zentraler Bedeutung für die Aufrechterhaltung der Zellfunktionen. Unterschiedliche Stoffwechselprofile ermöglichen es Zellen, ihre Funktionen an verschiedenste spezialisierte Nischen im Körper anzupassen. Dabei scheinen besonders Vitamine für Blutstammzellen wichtig zu sein: „Vitamine können als Cofaktoren von Enzymen wirken, die die Aktivität der DNA regulieren. Studien haben gezeigt, dass Vitamine die Blutkrebsentstehung hemmen, indem sie den DNA-Methylierungsstatus in HSZ verändern,” sagt Katharina Schönberger, Erstautorin der Studie.
Doch die Forschung mit diesen kleinen und oft flüchtigen Stoffwechselprodukten in HSZ ist äußerst schwierig. „Die geringe Anzahl von Blutstammzellen, von denen der Organismus nur ein paar Tausend besitzt, führt zu vielen technischen Herausforderungen. Wir haben im Laufe dieses Projekts einige Anstrengungen unternommen, um Protokolle und modernste Low-Input-omics-Verfahren zu etablieren. So konnten wir trotz nur kleiner Mengen biologischen Materials eine umfassende Untersuchung des Zusammenspiels zwischen Stammzellstoffwechsel, Transkription und Epigenetik durchführen,“ sagt Co-Erstautorin Nadine Obier aus dem Cabezas-Wallscheid-Labor.
Ein Vitamin A-Abfallprodukt steuert Funktionen der Blutstammzellen
Dabei fanden die Freiburger Forscher:innen heraus, dass einer der prominentesten Stoffwechselknotenpunkte in HSZ der Vitamin A/Retinsäure-Stoffwechsel (RA) ist. In Entwicklungsländern stellt Vitamin-A-Mangel ein durchaus ernstzunehmendes Problem der öffentlichen Gesundheit dar, das vor allem für Kindern schwere Folgen hat und unter anderem zu einem geschwächten Immunsystem und dementsprechend einer höheren Anfälligkeit für Infektionskrankheiten führt. Aktuelle Therapieansätze beruhen auf einer ergänzenden Gabe von Vitamin A. Allerdings kommt es nur in etwa 20 % der Fälle zu einer vollständigen Erholung des Immunsystems. In ihren Experimenten beobachteten die Forscher:innen bei Mäusen, die eine Vitamin-A-freie Diät erhielten, einen erheblicher Verlust von HSZ. Um den Mechanismus der Vitamin-A-Signalübertragung besser zu verstehen, führte das Team funktionelle in vitro- und in vivo-Knockout-Studien durch. Dabei zeigte sich eine bislang unbekannte RA-Signalachse, die die Funktion der HSZ reguliert. HSZ sind demnach auf ein Enzym namens Cyp26b1 angewiesen, von dem man üblicherweise annimmt, dass es die Wirkungen von RA in Zellen begrenzt, indem es das bioaktive at-RA zu 4-Oxo-RA abbaut. Im Gegensatz zur bisherigen Auffassung, zeigten jedoch die Daten der Forscher:innen, dass Cyp26b1 für die Produktion des aktiven Metaboliten 4-Oxo-RA unverzichtbar ist, der seine Signalwirkung hauptsächlich über den RA-Rezeptor beta (Rarb) entfaltet. Damit unterstreicht das Team von Nina Cabezas-Wallscheid, wie ein einziger Metabolit das Schicksal von Stammzellen steuern kann, indem er epigenetische und transkriptionelle Eigenschaften steuert.
NCW/MR






