Die ZNF451-Familie: eine neue Klasse von SUMO-Enzymen
Labor Pichler
Wir haben eine neue Klasse von SUMO-Enzymen mit E3-Ligase und E4-Elongase (spezialisierte E3s für die SUMO-Kettenverlängerung) Funktionen beschrieben (Abbildung 3, oberes Feld). Wir konnten zeigen, dass ZNF451 eine SUMO-E3-Ligase-Aktivität besitzt und effizient SUMO2/3-Ketten verknüpft. Detaillierte biochemische Analysen zeigten, dass ZNF451 anders funktioniert als alle bekannten E3-Ligasen, die für SUMO- und Ubiquitin-Konjugation beschrieben wurden: ZNF451 führt die Katalyse über ein Tandem-SIM und seine interSIM-Region aus.
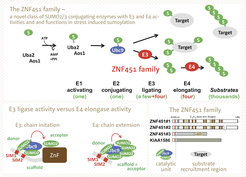
Ein SIM richtet das Donor-SUMO aus, während ein zweites SIM ein SUMO auf der Rückseite des E2-Enzyms bindet. Interessanterweise reicht diese kurze Tandem-SIM-Region aus, um eine an der Rückseite des E2’s verankerte SUMO-Kette zu verlängern (E4-Elongase-Aktivität), im Gegensatz zur Ketteninitiation, die zusätzlich eine Zinkfinger-Region benötigt, um das erste Akzeptor-SUMO zu rekrutieren (E3-Ligase-Aktivität, Abbildung 3, unteres linkes Feld). Vier menschliche Proteine teilen diese E4-Ligase-Aktivität (Abbildung 3, unteres rechtes Feld) und spielen eine zentrale Rolle in der stressinduzierten globalen Sumo(2,3)lierung nach DNA-Schädigung oder Hemmung des Proteasoms (Eisenhardt, Chaugule et al 2015 und Cappadocia et al 2015).
Wir haben neue Substrate für ZNF451#1 nach Stressinduktion identifiziert und untersuchen derzeit ausgewählte Kandidaten, um Einblicke in die biologische Funktion, Aktivierung und Substratspezifität von ZNF451#1 zu gewinnen.
